基因毒性杂质(genotoxic impurity,GTI)是指药物中能直接或间接导致DNA受损引起基因突变,并具有致癌性或者潜在致癌可能性的一类杂质。由于其较一般杂质具有微量水平就存在潜在致突变性和致癌性风险的特点,是受到药品监管机构和制药企业重点关注和控制的对象。
1、我国决定适用M7(R2)指导原则
2024年1月5日,国家药品监督管理局发布了决定适用《M7(R2):评估和控制药物中DNA反应性(致突变)杂质以限制潜在致癌风险》国际人用药品注册技术协调会指导原则(以下简称M7(R2)指导原则)的公告。
国家食品药品监督管理局于2016年发布的《化学药品新注册分类申报资料要求(试行)》(2016年 第80号)中提到过“结合起始原料和本品的制备工艺,简述对原料药可能存在的基因毒性杂质所进行的分析和研究的结果,并按照ICH M7指导原则的要求说明控制的策略”。
我国药监部门于2017年6月加入ICH,后续2020版中国药典四部通则部分,添加了《9306遗传毒性杂质控制指导原则》,该指导原则的内容要求与ICH M7基本一致。
如今国家药品监督管理局发布了决定适用M7(R2)指导原则的公告,国内医药企业对于相关药品遗传毒性杂质的控制应符合M7(R2)的指导要求。
2、M7(R2)适用范围及企业适用情形
适用于新原料药和新制剂临床研究和后续上市申报阶段。
适用于已上市药品的上市后信息变更、以及在已上市制剂中使用的原料药用于新制剂时的上市申请:
◇ 变更了原料药合成工艺,导致产生了新杂质或提高了已有杂质限度;
◇ 变更了处方、组分或生产工艺,导致产生了新降解产物或提高了已有降解产物限度;
◇ 变更了适应症或给药方案,显著影响了可接受的致癌风险水平。
本指导原则不适用于以下类型的原料药和制剂中杂质潜在致突变性的评估:
◆ 生物/生物技术制品;
◆ 肽类;
◆ 寡核苷酸;
◆ 放射性药物;
◆ 发酵产品;
◆ 草药;
◆ 动物或植物来源的粗制品;
◆ ICH S9所定义的拟用于晚期癌症适应症的原料药和制剂;
◆ 矫味剂;
◆ 着色剂;
◆ 香料;
◆ 已上市药物中使用的辅料;
◆ 药物包材相关的可浸出物。
详细的ICH M7指导原则适用情形请参考表1。
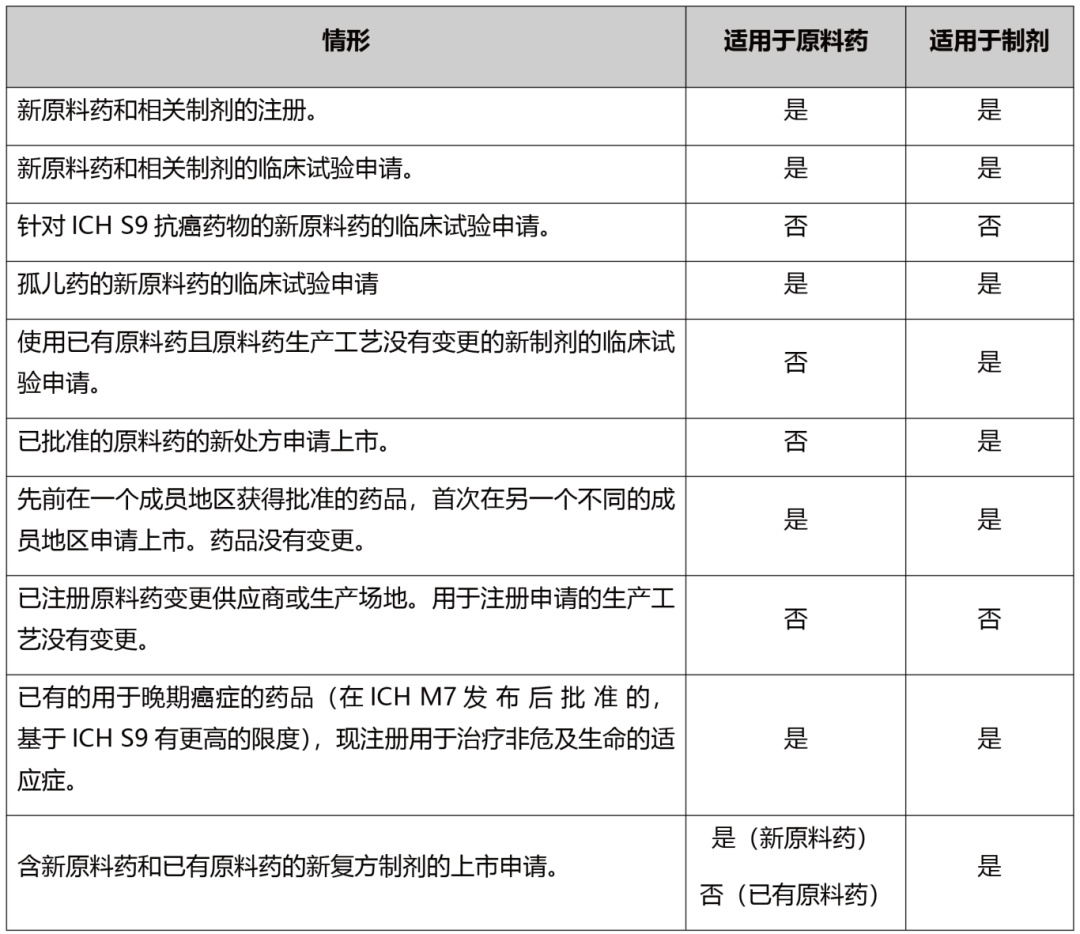
表1 ICH M7指导原则适用情形
3、杂质评估条件
应对新原料药合成和贮藏期间以及新制剂生产和贮藏期间实际产生的和潜在的杂质进行评估。
需要评估致突变性风险的杂质包含:
👉 原料药如果在合成和贮藏期间,实际产生的合成和降解杂质水平超过ICH Q3A所述的鉴定限度。
👉 制剂如果在生产和贮藏期间,实际产生的合成和降解杂质水平超过ICH Q3B所述的鉴定限度。
👉 可能存在于最终的原料药或制剂中的合成和降解杂质,并且在结构已知的情况下,应评估其致突变性。
4、杂质危害评估
通过数据库和文献的检索以及QSAR计算,可将杂质划分五个类别,即1类/2类/3类/4 类/5类,分类信息与流程请分别参考表2和图5。
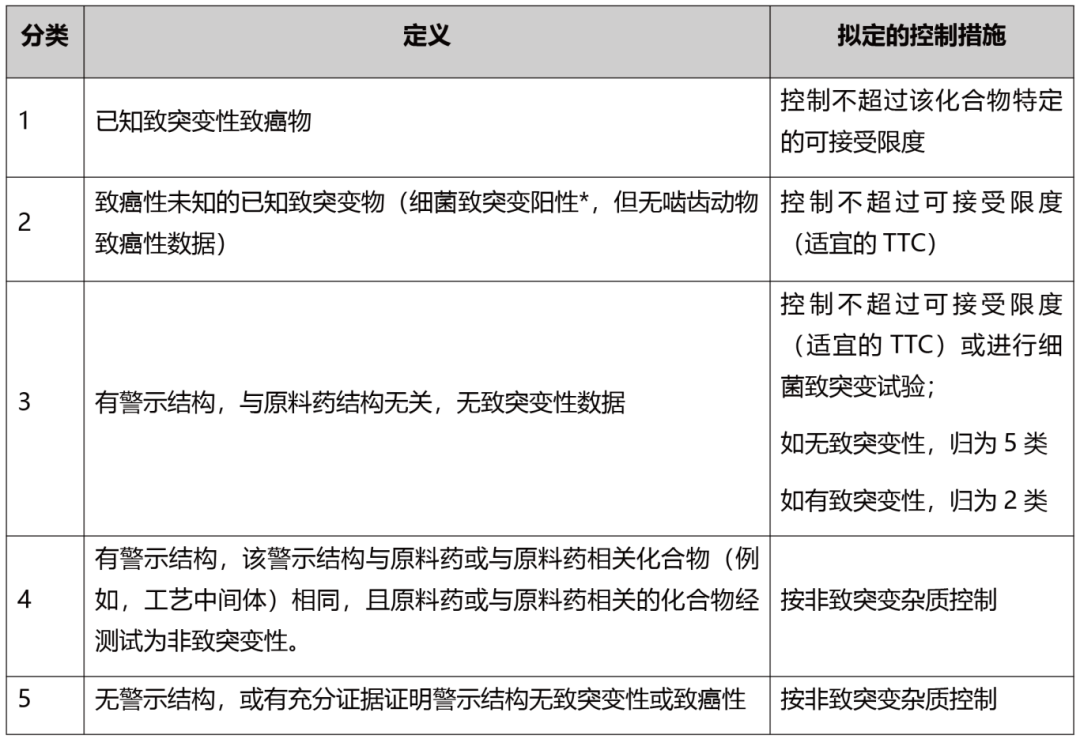
表2 根据致突变性和致癌性对杂质进行分类及控制
注:*或其它相关的阳性致突变性数据,这些数据可指示DNA反应活性相关的基因突变(例如,体内基因突变研究显示阳性)。
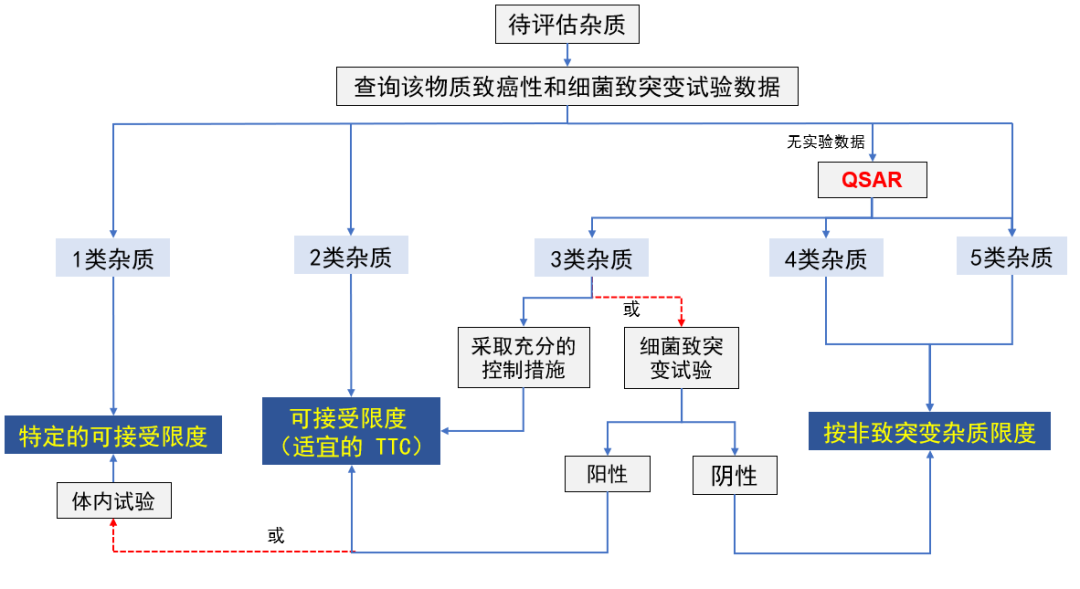
图5 杂质致突变性分类评估流程
危害性评估首先通过对数据库和文献检索获得的杂质致癌性和细菌致突变数据对实际和潜在杂质进行初步分析,根据表1将其归为1类,2类或5类。如果无法获得这样的分类数据,则应进行预测细菌致突变性的(定量)构-效关系((Q)SAR)评估。根据评估结果将杂质归为3类、4类或5类。
ICH M7(R2)推荐采用(Q)SAR方法学进行毒性评估,并指出应采用两种互补的(Q)SAR 预测方法。一种方法应基于专家规则,另一种方法应基于统计学。
(Q)SAR模型采用的预测方法学应遵循经济合作与发展组织(OECD)制订的一般的验证原则。如果经两种互补的(Q)SAR方法(专家规则和统计学)预测均没有警示结构,则足以得出该杂质没有致突变风险的结论,不建议做进一步的试验(归为表1中的5类)。
对计算机系统得到的任何阳性、阴性、相互矛盾或无法得出结论的预测结果,如有必要,申请人可根据专业知识进行综合评估,提供进一步支持性证据,合理论证并得出最终结论。
5、风险表征
每个杂质应按表1中的5个类别进行分类,然后根据导则推导1、2、3 类杂质可接受摄入量的风险表征:
✍️ 基于特定化合物的风险评估数据制订可接受摄入量:
1类杂质按照特定的可接受限度进行风险表征(已有的特定可接受限度或根据TD50线性外推法推导特定的可接受限度)。
✍️ 基于毒理学关注阈值(TTC)指定可接受摄入量:
2、3 类杂质按照可接受限度进行风险表征。
6、控制
企业/公司根据M7(R2)指南准则对1、2或3类杂质进行控制。
控制策略是一套基于对当前产品和对工艺的理解而制订的有计划的控制方法,用以保证工艺性能和产品质量。
参考文献:
[1] 万君玥,陈华,尹婕.化学药品中杂质的基因毒性评估策略以及相关分析方法研究进展[J].药物分析杂志,2022,42(04):557-571.
[2] 文海若,闫明,王亚楠等.药物杂质遗传毒性评价策略与监管研究[J]. 中国药事, 2020, 34 (02): 131-140.
[3] 国家食品药品监督管理总局.总局关于发布化学药品新注册分类申报资料要求(试行)的通告(2016 年 第80 号)
[4] M7(R2):ASSESSMENT AND CONTROL OF DNA REACTIVE (MUTAGENIC)IMPURITIES IN PHARMACEUTICALS TO LIMIT POTENTIALCARCINOGENICRISK .
[5] M7(R2):评估和控制药物中DNA反应性(致突变)杂质以限制潜在致癌风险.

合律曼服务
✍️ 化学品注册QSAR预测
✍️ 医药ICH M7 QSAR分析
✍️ 农药登记QSAR服务
✍️ QSAR建模服务
✍️ QSAR软件服务
※ 合律曼小助手已上线,欢迎添加VX:compliancemen,实时在线咨询,掌握最新合规资讯
※ 版权声明:本文由合律曼数据翻译整理,转载请注明出处!合律曼数据尊重知识产权,如内容涉及版权问题,烦请联系我们及时处理。合律曼数据随时为您更新化工新材料合规&数据跨境相关资讯,如有工业化学品REACH | 数据生产AI模型 | 数据标准与跨境交易 | 计算毒理QSAR | 全球SDS报告等相关问题欢迎咨询联系0571-86060701或点击下方图片在线咨询!
上一页:专家解读:土耳其KKDIK临时注册正式启动!相关企业尽快应对合规
下一页:无
地址:浙江省杭州市拱墅区储鑫路21号网谷创新中心8幢903室
邮箱:info@compliancemen.com
QQ:3671987934

微信咨询

微信公众号
2012-2025 杭州合律曼数据服务有限公司版权所有 All Right Reserved 浙ICP备2025192110号-1